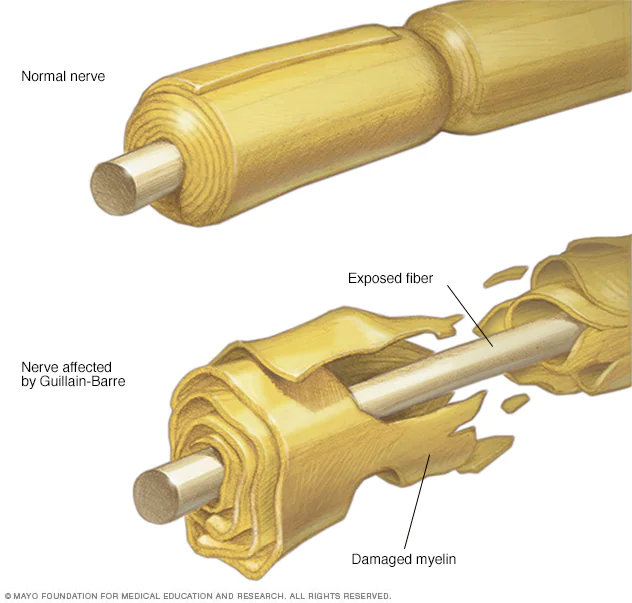
بیماری گیرن باره چیست؟
خلاصه مقاله
گیلن باره یک بیماری خطرناک پیشرنده است که
#با_مقاله_درس_بخوانیم
#Guillain_Barre_Syndrome
واکسن ها و سندروم گیلن-باره
افزایش نظارت بر سندرم گیلن باره مرتبط با تجویز واکسن به دلیل گزارشهایی مبنی بر افزایش خطر ابتلا به سندرم گیلن باره (تقریباً یک مورد از هر 100000 واکسن) در افرادی که واکسن آنفولانزای H1N1 در سال 1976 دریافت کرده بودند، انجام شد.
البته واکسیناسیون خطر ابتلا به عود را در افرادی که قبلاً به سندرم گیلن باره مبتلا شده بودند افزایش نداد.
Immune checkpoint inhibitors و سندروم گیلن-باره
با معرفی مهارکننده های ایمنی به عنوان دارو در درمان سرطان، سرطان هایی که قبلا غیر قابل درمان بودند، اکنون بهبود یافته اند. عوارض جانبی عصبی، هرچند نادر، گزارش شده است، از جمله وضعیتی شبیه به سندرم گیلن باره.
میانگین زمان شروع در بیماران مبتلا به سندرم گیلن باره معمولاً پس از سه دوره درمان با مهارکننده های ایمونولوژیک بود و پیشرفت بیماری سریع بود.
توصیه درمانی کنونی برای عوارض عصبی ناشی از درمان با مهارکننده های ایمونوتیک، توقف داروی مسبب و شروع مصرف استروئیدها است.
با این حال، از آنجایی که به نظر می رسد سیر بالینی سندرم گیلن باره ناشی از مهارکننده های ایمنی شبیه به سندرم کلاسیک گیلن باره است، ایمونوگلوبولین وریدی یا تبادل پلاسما باید در نظر گرفته شود.
نقش آنتیبادیها
گانگلیوزیدها گلیکولیپیدهای حاوی اسید سیالیک هستند که در سیستم عصبی پستانداران، به ویژه در گره های Ranvier و پایانه های عصبی حرکتی غنی شده اند. اهمیت آنها به عنوان هدف در موشهای تراریخته نشان داده شده است که گانگلیوزیدهای پیچیده را منحصراً در نورونها بیان میکنند. مکانیسم اساسی برای نوروپاتی با واسطه آنتیبادی شامل تعدیل عملکرد کانال یونی در گرههای Ranvier، سمیت سلولی وابسته به مکمل در گرهها و پایانههای عصبی حرکتی، و تداخل با بازسازی عصبی.
زیرگروه های سندرم گیلن باره اغلب با آنتی بادی های آنتی گانگلیوزید خاص همراه هستند که نشان دهنده غنی سازی نامتناسب گلیکولیپیدهای هدف در اعصاب مختلف است.
معیارهای تشخیصی
معیارهای متعددی برای کمک به پزشکان در تشخیص سندرم گیلن باره ایجاد شده است.
حداقل، تشخیص سندرم گیلن باره مستلزم وجود ضعف متقارن شل و کاهش رفلکس در غیاب علل جایگزین است.
معیارهای برایتون همچنین تعریف مورد جداگانه ای را برای سندرم میلر فیشر در نظر می گیرد، که نیاز به حضور سه گانه بالینی افتالمپلژی دو طرفه، کاهش رفلکس ها و آتاکسی، همراه با فقدان ضعف اندام و درگیری CNS برای تحقق یک قطعیت تشخیصی سطح 3 دارد.
دستیابی به قطعیت های تشخیصی بالاتر در هر دو سندرم گیلن باره و سندرم میلر فیشر مستلزم وجود یک بیماری تک فازی است که در عرض 28 روز به حد نادر می رسد، تجزیه آلبومین سیتولوژیکی مایع مغزی نخاعی و شواهد الکترودیاگنوستیک نوروپاتی.
در عمل، ویژگی های بالینی سندرم گیلن باره متغیر است. اگرچه در هیچ یک از معیارهای تشخیصی گنجانده نشده است، یک بیماری پیشین در 4 هفته قبل در 76٪ از بیماران وجود دارد.
الگوی ضعف در سندرم گیلن باره به اندام ها نیز محدود نمی شود و می تواند شامل عضلات عصب دهی شده جمجمه، عضلات تنفسی و درگیری اتونوم شود. به ندرت، این الگوهای غیر معمول می تواند اولین تظاهر سندرم گیلن باره باشد.
امروزه هم از معیارهای تشخیصی برایتون و هم معیارهای موسسه ملی اختلالات عصبی و سکته مغزی ایالات متحده (NINDS) استفاده میشود.
گیلن باره در کودکان
تشخیص سندرم گیلن باره در کودکان می تواند چالش برانگیز باشد. با این حال، درد قابل توجهی در ارتباط با سندرم گیلن باره کودکان وجود دارد که می تواند ضعف اندام را بپوشاند و باعث تاخیر در تشخیص شود. هنگامی که مطالعات هدایت عصبی در کودکان قابل تحمل نباشد، تصویربرداری عصبی با MRI یا اولتراسوند می تواند تشخیص را تسهیل کند. کودکان مبتلا به سندرم گیلن باره پیش آگهی خوبی دارند، اما از آنجایی که گزارش هایی از مرگ و میر ناشی از اختلال عملکرد اتونوم وجود دارد، استراتژی های درمانی، همانطور که در سندرم گیلن باره بزرگسالان توصیه می شود، توصیه می شود.
گردآورنده: ساغر مومنی
ادیت:دکتر فرزان فهیم
🆔 @Neurosurgery_association
مقالات مرتبط
مننژیوما
مننژیوما یکی ازتومورهای اولیه سیستم عصبی مرکزی است که در نخاع یا مغز بروز میکند و منشأ تومور از سلولهای مننژ و عنکبوتیه است. این تومور معمولاً خوشخیم است.تشعشعات یونیزان ، ریسک بیماری را از شش تا ده برابر بیشتر است. سندروم ارثی میتوانند زمینه را برای بروز مننژیوما فراهم کنند.مانند نوروفیبروماتوز نوع 2 (NF2) , Li-Fraumeni، Gorlin، von Hippel-Lindau، بیماری Cowden و نئوپلازی غدد درون ریز متعدد (تیپ1). هورمونهای جنسی بهعنوان عوامل خطر دیگر برای ایجاد مننژیوم مطرح میشوند. افزایش بروز بیماری پس از بلوغ در زنان (2:1 در مقابل مردان) و همچنین در طول دوره باروری (حدود 3:1) مطرح کننده این موضوع میباشد. ویژگی بافت شناسی پاتوگنومونیک مننژیوم، تشکیل whorls است که در نهایت به اجسام پساموما تبدیل می شوند. نشانگرهای ایمونوهیستوشیمی برای شناسایی مننژیوم عبارتند از: آنتی ژن غشای اپیتلیال، گیرنده سوماتوستاتین 2A، گیرنده پروژسترون و گیرنده استروژن ؛ آنتی ژن غشای اپیتلیال میباشد. WHO براساس ویژگی های هیستوپاتولوژیک: فعالیت میتوز ، تهاجم مغزی، و یا حداقل سه ویژگی تهاجمی دیگر مانند sheeting ، نسبت هسته به سیتوپلاسم بالا، هسته برجسته، سلولاریتی بالا و نکروز خود به خودی ، مننژیومها را طبقه بندی کرده و سه درجه بدخیمی را ذکر کرده است: مننژیوم های درجه یک می توانند طیف وسیعی از الگوهای بافت شناسی مختلف را ارائه دهند این الگوها عبارتند از: مننژوتلیال و فیبروز ، انتقالی، psammomatous,، angiomatous,، microcystic,، ترشحی، غنی از لنفوپلاسمیت و متاپلاستیک. از معیارهای طبقه بندی طیف درجه 1 : نرخ میتوز پایین، 4 در 10 HPFs و عدم تهاجم مغزی میتوان اشاره کرد. مننژیوم درجه 2 حداقل 3 ویژگی از ویژگی های زیر است: افزایش سلولاریتی، سلول های کوچک با نسبت بالای هسته به سیتوپلاسم، هسته برجسته، رشد مداوم بدون الگو یا رشد ورقه مانند، و کانون های نکروز خود به خود یا جغرافیایی. این طیفمی توانند بافت شناسی سلولی واضح و کوروئیدی داشته باشند. مننژیوم درجه 3 با ویژگی های بافتی بدخیمی تعریف میشود. چنین ویژگی هایی شامل سیتولوژی بدخیم (مانند ظاهری شبیه به سارکوم، کارسینوم یا ملانوم) یا شاخص میتوزی بالا است. زیرگروه هایی که دارای پتانسیل بیشتری برای تکثیر هستند، با درجه های II و III همراه هستند. اکثرا بدون علامت هستند ولی به محل درگیری ارتباط دارند. مننژیوم ها در تمام قسمت های جمجه یافت میشوند؛ خصوصا در ناحیه پاراساژیتال، و به دنبال آن فاکس، سینوس کاورنوس، توبرکلوم سلا، Lamina Cribrosa، تورامن مگنوم و Torcular Zones. علائمی همچون سردرد ، نقایص نورولوژیک کانونی یا تشنج عمومی و جزئی ، تیپیکال هستند. تغییرات شخصیتی، سردرگمی و تغییر سطح هوشیاری را میتوان مشاهده کرد و ممکن است به اشتباه به عنوان زوال عقل یا افسردگی تشخیص داده شود. مننژیوم های ستون فقرات اغلب در ناحیه توراسیک قرار دارند. هر فردی که اخیراً تشنج های او شروع شده یا علائم عصبی کانونی دارد که احتمال میرود با توده داخل جمجمه ارتباط داشته باشد، باید تحت تصویربرداری رزونانس مغناطیسی از مغز قرار گیرد. تشخيص آن راديولوژيك است و اگر تصويربرداري قویا حاكي از مننژيوم باشد، بيوپسي(روش تشخیص قطعی) اجباري نيست. در هر روش تصویربرداری، مننژیوم ها ویژگی های بسیار مشخصی را نشان می دهند که امکان تشخیص دقیق آنها را فراهم می کند و امروزه حتی سرنخ هایی برای تشخیص های بافت شناسی نیزارائه میدهند. بیشتر توده های کانونی و خارج محوری مننژیوم هستند و گاهی اوقات وجود جریان(شکاف) CSF در مجاورت تومور دیده می شود. تصویربرداری رزونانس مغناطیسی (MRI) روش استانداردی برای تشخیص رادیولوژیکی و نظارت بر مننژیوم است. میتوان از آن برای افتراق بین عود مننژیوم های تحت درمان با جراحی و تغییرات رادیولوژیک مرتبط با درمان (مانند ضخیم شدن دورا) استفاده کرد. در CT، کلسیفیکاسیون داخل ضایعه تغییرات استخوانی(هیپراستوز)، افزایش علائم عروقی و کلسیفیکاسیون پساموماتوز نیز دیده میشود. در اسکن های CT و MRI، مننژیوم ها به صورت بدون تکیه و یا ساقه دار(dural tail) با ظاهری ایزودنس و لکه مانند(به دلیل تشکیل عروق) دیده میشوند. مننژیوم خوش خیم دارای dural tail ضخیم و تقویت کننده کنتراست خواهد بود.نکروز مرکزی (hypointense T1، غیر تقویت کننده) را می توان در هر دو مننژیوم خوش خیم و بدخیم مشاهده کرد. درگیری عروق مغزی یک ویژگی شایع است، به ویژه برای مننژیوما های قاعده جمجمه، که ممکن است به شریان های کاروتید و بازیلار یا شاخه های آنها نزدیک شود. برای مننژیوم قاعده جمجمه، 18-fluoro-ethyl-tyrosine PET می تواند به تشخیص کمک کند. سایر تشخیصهای افتراقی شامل دیگر بیماریهای عفونی، التهابی یا نئوپلاستیک است که دورا یا فضای ساب دورال را درگیر میکنند، مانند متاستاز سایر تومورها، پلاسماسیتوما، لنفوم، تومور فیبری منفرد، گلیوسارکوم، سارکوئیدوز، گرانولوماتوز و سل. درمان 1)جراحی: برای تومورهای در حال رشد و علامت دار، استاندارد مراقبت یک رویکرد جراحی است. مکان نوروآناتومیک تومر، رویکرد جراحی را تعیین میکند؛ به طور مثال تومورهای پاراساژیتال ، با وجود سطحی بودن اما به دلیل درگیری سینوس ساژیتال ، پیچیده محسوب میشوند. تکنیکهای جدید جراحی شامل رویکردهای آندوسکوپی، جراحی هدایتشده با تصویر، مانیتورینگ عصبی، یا استفاده از ناوبری حین عمل و سیستمهای نوری است که امکان تجسم گستردهتر حین عمل را فراهم میکند. روش های آندوسکوپی از طریق حفره بینی برای درمان مننژیوم های موضعی در شیار بویایی، planum sphenoidale و tuberculum استفاده شده است.رادیوتراپی کمکی با هدف کاهش خطر عود و بهبود کنترل موضعی، مفید است. هنگامی که تومور برداشته می شود، از نوعی چسب برای جایگزینی دورا استفاده می شود. گسترش میزان برداشت(برش) از بافت با درجه سیمپسون اندازه گیری می شود و در پنج دسته قرار میگیرند: 1. برداشتن کامل، با برداشتن دورا و استخوان 2. برداشتن کامل کامل با انعقاد دورال 3. برداشتن ماکروسکوپی، بدون برش دورال یا انعقاد 4. برداشتن ساب توتال 5. بیوپسی جراحی می تواند عوارض عصبی، عصبی شناختی و عملکردی ایجاد کند و کیفیت زندگی این بیماران را محدود می کند. 2)پرتو درمانی: اگر برداشتن ساب توتال یا عوارض عمل جزء پیامدهای احتمالی باشد، باید به عنوان یک رویکرد درمانی اولیه در نظر گرفته شود. و برای کنترل رشد موضعی تومور استفاده میشود. در مننژیوم های درجه 1 در صورت برداشت ناقص در مناطق پرخطر مانند سینوس کاورنوس میتواند از رادیوتراپی استفاده کرد. در مننژیوم های درجه دو، نقش پرتودرمانی کمکی هنوز بحث برانگیز است، اما در موارد برداشت ناقص می توان آن را مد نظر قرار داد. مننژیوم درجه III با خطر بالاتر عود بعد از برداشتن همراه است، بنابراین رادیوتراپی با دوز بالا بعد از عمل استاندارد مراقبت است و با بهبود کنترل موضعی در ارتباط است. 3)درمان های سیستمیک: عوامل شیمی درمانی سیتوتوکسیک بررسی شده اثربخشی محدودی داشته اند و با دستورالعمل های اجماع توصیه نمی شوند.
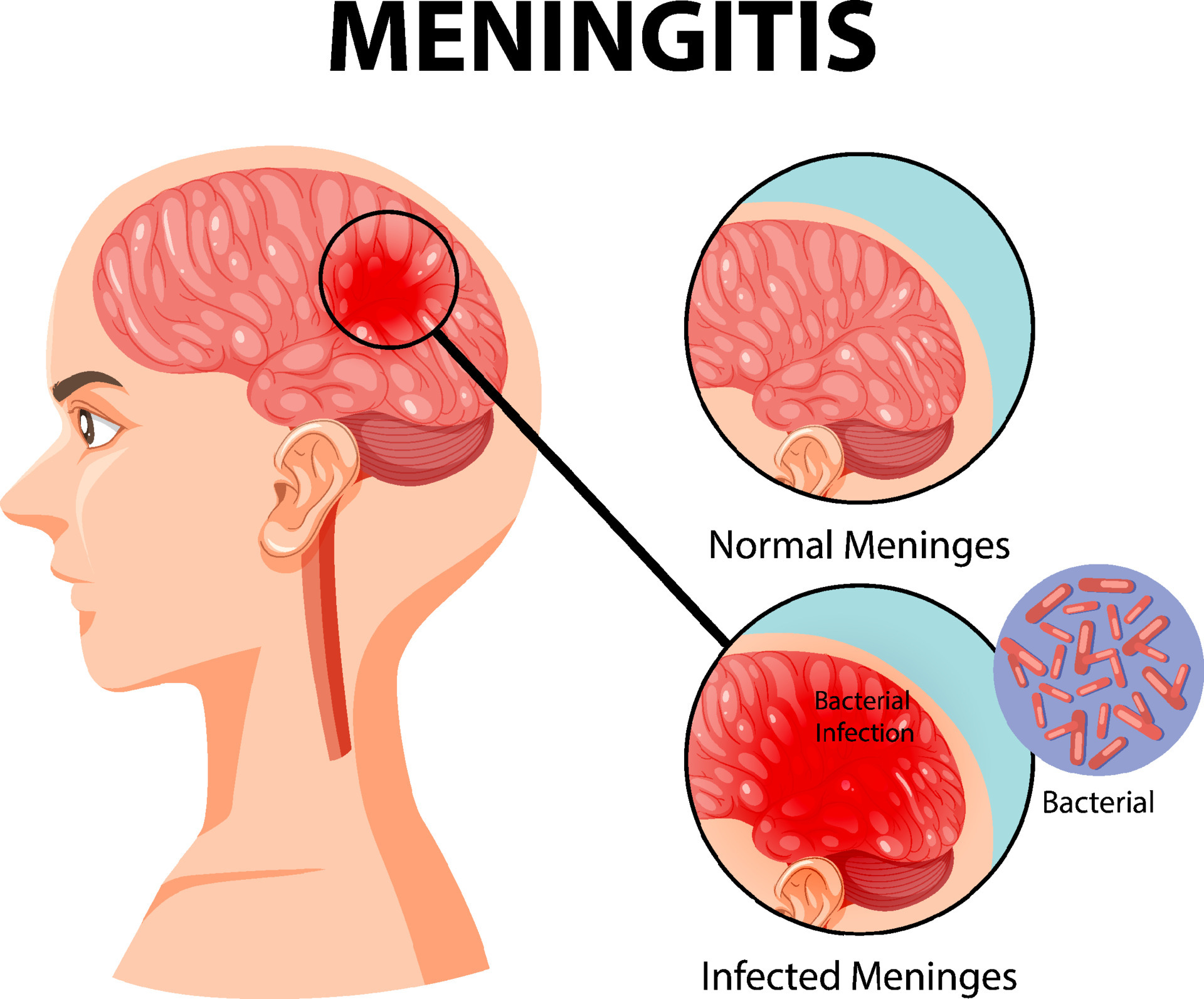
بررسی بروز و وقوع مننژیت پس از کرانیوتومی، در یک مطالعه ی گذشته نگر.
مننژیت یکی از شرایط اورژانسی در بیماران جراحی مغز و اعصاب است که میتواند تهدید کننده ی حیات باشد.این شرایط بویژه بعد از جراحی اعصاب دیده میشود.